UDI-Lasermarkierung: Was bis 24.09.2022 für Klasse I-Produkte zu beachten ist
Nicht nur in der Dentalmedizin sind viele Fragen offen, wenn es um die Direktmarkierung wiederverwendbarer Instrumente geht. FOBA gibt Antworten im Hinblick auf die anstehende letzte FDA-Umsetzungsfrist.
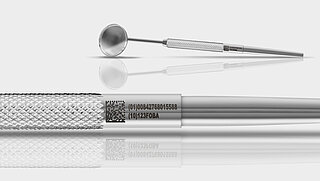
Ab dem 24. September 2022 müssen wiederverwendbare und mehrfach aufbereitete Medizinprodukte aller Risikoklassen auf dem amerikanischen Markt gemäß FDA-Regulatorien eine UDI-Direktmarkierung aufweisen. Dies betrifft nach den Risikoklassen III und II dann auch die Klasse I-Produkte wie Chirurgie-Instrumente, Dentalsonden, medizinische Bohrer und viele mehr.
Im Zusammenhang mit der bevorstehenden Frist bietet FOBA Unterstützung bei der regelkonformen technischen Umsetzung der industriellen Laserbeschriftung. Der direkt markierte UDI-Code muss nämlich Qualitätskriterien erfüllen, die eine dauerhafte Lesbarkeit der UDI bei vielfacher Wiederaufbereitung gewährleisten. Ebenso muss der Markierprozess vollständig validiert und die UDI über die GUDID Datenbank registriert sein.
Hersteller, die bereits für die USA geforderte UDI-Maßnahmen getroffen haben, sind für die MDR-Bestimmungen, die in Europa anlaufen, gut aufgestellt. Aber auch für Europa steht vielen die aufwändige Validierung und EUDAMED-Registrierung noch bevor. Somit steigt der Zeitdruck, und gleichzeitig gibt es in Bezug auf die regelkonforme Umsetzung der Direktmarkierung nach wie vor viele Unklarheiten.
Eine Auswahl der häufigen Fragen und Antworten aus Webinaren und dem engen Austausch von FOBAs Lasermarkierexperten mit Medizintechnik-Herstellern haben wir zusammengestellt:
Muss das Verfallsdatum eines Medizinprodukts in der UDI angegeben werden?
Die UDI besteht aus zwei Hauptbestandteilen:
- die DI (Device Identification, z.B. als GTIN) steht für eine weltweit eindeutig definierte Produktart
- nachfolgend die PI (Production Identification), die ein einzelnes Produkt individuell kennzeichnet
Das Verfallsdatum muss immer in der PI-UDI angegeben werden. Sollte kein Verfallsdatum verfügbar sein, muss das Herstelldatum angegeben werden.
Außerdem umfasst die PI-UDI folgende Pflichtbestandteile:
- Chargennummer (Batch oder Lot Nummer)
- Seriennummer (wenn vorhanden; nach Möglichkeit Chargen- und Seriennummer)
- Ggfs. Softwareidentifikation
Welche Qualitätsstandards muss eine UDI Markierung erfüllen?
Bei der Verifikation des Codes sollte man nach FDA mindestens den Qualitätsgrad C, besser B oder A, erreichen. Dies muss über den gesamte Lebenszyklus, also auch nach vielfacher Wiederaufbereitung eines Produkts, möglich sein.
Die Lesbarkeit des Codes kann durch einen aufgehellten Hintergrund noch verbessert werden. Das Laserverfahren, mit dem man zunächst den Hintergrund aufhellt, nennt man Frosting.
Werden die Zwischenräume und der Hintergrund eines Datamatrix-Codes weiß markiert, spricht man von der Schwarz-Weiß-Markierung.
Muss auch auf sehr kleinen Produkten (z.B. rotierende zahnärztliche FG-Bohrer mit 1,6 mm Durchmesser, die wiederaufbereitet werden) eine UDI direkt markiert werden?
Grundsätzlich besteht für wiederaufbereitete Klasse I-Produkte die Direktmarkierpflicht. Somit muss die auf dem Produkt markierte UDI auch die generell geforderte Form einhalten, d.h. sowohl in Klarschrift als auch als maschinenlesbarer Code dargestellt sein.
Jedoch gibt es Ausnahmen:
- wenn die Beschriftung die Sicherheit oder die Leistung des Artikels beeinträchtigt, oder
- wenn die technische Umsetzung nicht möglich ist.
In welchen Fällen ist die technische Umsetzung der UDI-Markierung nicht möglich?
Sollte der Platz nicht ausreichen, um den vollständigen Code zu markieren, muss zumindest der AIDC-Code aufgebracht werden.
Ist der Platz auf der Produktoberfläche so knapp, dass auch die Mindestgröße für den maschinenlesbaren UDI-Code nicht eingehalten werden kann, ist eine Markierung technisch nicht möglich.
Dann muss allerdings in der technischen Dokumentation erläutert werden, dass der Platz nicht ausreicht. Darüber hinaus muss die vollständige UDI zumindest auf den Verpackungen sowie Umverpackungen des Produkts aufgebracht werden.
Wie klein kann/darf ein UDI-Code sein, was ist also die Mindestgröße für die Markierung?
Die maschinenlesbare UDI kann entweder als Datamatrix oder als linearer Barcode dargestellt werden. Den geringsten Flächenbedarf haben Datamatrix-Codes, während Barcodes bei gleicher Informationsdichte mehr Platz benötigen.
Um die geforderte Lesbarkeit des AIDC („Automatic Identification and Data Capture“)-Codes mittels Code-Verifier zu gewährleisten, gibt es für Datamatrix-Codes Mindest-Modulgrößen. So liegt für die Lasermarkierung nach GS1-Standards die kleinste Modulgröße bei 0,1 mm (0.0039 Inches). Die gesamte Breite und Höhe des DMC bemisst sich dann jeweils nach der Menge der verschlüsselten Daten zuzüglich der auf allen vier Seiten hinzugefügten Hellzone von jeweils einer Modulbreite.
Für tintenbasierte Codemarkierung gibt GS1 eine Mindestgröße des X-Moduls von 0,254 mm (0.1 Inches) vor, da die erzielte Kontrastschärfe hier geringer ist als bei der Lasermarkierung.
Was ist eine praktikable Größe eines Datamatrix-Codes?
FOBA empfiehlt im Allgemeinen ein DMC-Flächenmaß von ab ca. 2,5 x 2,5 mm (0.0984 x 0.0984 Inches). Damit gewährleistet man, dass weitgehend alle Arten von Verifiern den Code erfassen können.
So funktioniert die Qualitätskontrolle dann auch in der Zahnarztpraxis mit Lesegeräten, die einfacher sind im Vergleich zu den in der industriellen Produktion eingesetzten Verifiern.
Lesen Sie auch weitere FOBA-Blogartikel mit detaillierten Informationen zu Datamatrix-Codes:
Wissenswertes zur Kennzeichnung von Produkten mit DataMatrix-Codes (Teil 1)
Optimierung von DMCs – Wissenswertes zu DataMatrix-Codes (Teil 2)
Bis wann müssen Medizinprodukte in die EUDAMED Datenbank eingetragen sein?
Nachdem die MDR am 26. Mai 2021 in Kraft getreten ist, wurde aufgrund der Corona-Krise und aufgrund von Engpässen bei den Benannten Stellen die Inbetriebnahme der EUDAMED Datenbank sowie die Pflicht zur dortigen Registrierung auf den 26. Mai 2022 verschoben. Grundsätzlich müssen ab diesem Zeitpunkt alle neu in Verkehr gebrachten Produkte eine UDI erhalten und dort eingetragen werden.
Für bereits länger auf dem Markt befindliche Produkte gelten Übergangsfristen bis 26. Mai 2024. Diese Fristverlängerung ermöglicht das weitere Inverkehrbringen von „Altprodukten“ unter der Voraussetzung, dass vor dem 26. Mai 2021 für Klasse I Produkte eine Konformitätserklärung unter Mitwirkung einer benannten Stelle erstellt wurde. Genauso sind andere Produkte, für die bereits fristgerecht gültige Zertifikate existieren, weiterhin nach den Anforderungen der MDD 93/42/EWG noch erlaubt.
Aber: In die EUDAMED Datenbank müssen Altprodukte trotzdem eingetragen werden. Diese benötigen dafür jedoch noch keine UDI. Um sie trotzdem systemkonform registrieren zu können, erhalten sie von der EUDAMED speziell vergebene Identifikationsnummern.
Wann sollte man anfangen, die Direktmarkierung umzusetzen?
Gemäß den MDR-Vorgaben ist zum Beispiel eine UDI-Direktmarkierung von Klasse III-Produkten erst ab Mai 2023 verpflichtend. Man muss jedoch einkalkulieren, dass der gesamte Prozess bis zur Implementierung der bestmöglichen Markierlösung mehrere Monate dauern kann.
Den größten zeitlichen Anteil hat dabei die Maschinen- und Prozessvalidierung. Daher sind eine gute Vorbereitung und rechtzeitige Planung der Aufgabenverteilung vorab für die Validierung wichtig.
Kann FOBA die Validierung des Markiervorgangs mit dem Markiersystem gleich mitliefern?
FOBA unterstützt seine Kunden bei der IQ-OQ-PQ-MQ, kann und darf jedoch selbst keine Validierung der Prozesse anbieten. Diese muss direkt am jeweiligen Produktionsort erfolgen. Ein erfahrener externer Validierungspartner kann dabei unterstützen, zu dem FOBA gern den Kontakt herstellt.
Zu beachten ist, dass eine Validierung ca. alle drei Jahre wiederholt werden muss. In bestimmten Fällen, wie beispielsweise bei einer räumlichen Veränderung, wird sogar zusätzlich validiert werden müssen, weil sich dann zum Beispiel die Lichtverhältnisse ändern können.